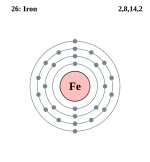
Fierul este un element chimicmetalic, notat cu simbolul Fe . Numărul său atomic este 26, iar masa atomică este 56. Fierul se află în grupa a 8-a şi perioada 4, fiind astfel clasificat ca un metal tranziţional. Fierul şi aliajele sale (oţelurile) sunt pe departe cele mai comune materiale feromagnetice folosite zilnic. Suprafeţele proaspete de fier sunt lucioase şi au o culoare gri-argintie, care se oxidează în aer, formând un strat roşu sau brun de oxid feric sau rugină. Cristalele pure de fier sunt moi (mult mai moi ca şi aluminiul), iar adiţia unor cantităţi de impurităţi, cum ar fi carbonul, le creşte rezistenţa în mod semnificativ. Producerea aliajelor de fier cu cantităţi potrivite din alte metale şi carbon, precum oţelul, face ca aliajul să fie de 1,000 ori mai rezistent decât fierul pur.
Izotopul 56Fe este cel mai greu izotop stabil rezultat din procesul alfa din nucleosinteza stelară; elementele mai grele decât fierul şi nichelul sunt necesare producerii unei supernove. Este metalul cel mai abundent în nucleul giganţilor roşii, şi cel mai abundent metal în meteoriţi. Este cel mai dens metal în nucleulplanetelor, precum Pământul.
Primul tip de fier cunoscut şi utilizat de oameni provenea din meteoriţi. În Egipt şi Mesopotamia s-au descoperit vărfuri de suliţă şi obiecte decorative cu această origine, datând din jurul anului 4000 î.Hr. [3] 2000 de ani mai târziu a apărut şi fierul prelucrat din minereu (la început cel numit fier de mlaştină - în engleză bog iron, sau limonit), folosit însă doar pentru obiecte de cult şi considerat mai valoros decât aurul. Între 1600 î.Hr. şi 1200 î.Hr. a început obţinerea fierului în topitorii primitive, în Imperiul Hitit (Anatolia şi Caucaz). Dispariţia acestui imperiu a permis răspândirea cunoştinţelor despre prelucrarea fierului în toată regiunea, facilitând trecerea de la Epoca Bronzului la Epoca Fierului.
În jurul anului 550 î Hr. în China a fost inventat furnalul şi s-a obţinut prima fontă turnată.
Oţelul, aliaj al fierului cu relativ puţin carbon, a fost produs, se pare, pentru prima dată în India, în secolul al III-lea. Un exemplu al măiestriei indiene în domeniul metalurgiei este şi faimoasa coloană de fier din Delhi, care este constituită în proporţie de 98% din fier forjat şi a fost ridicată la sfârşitul secolului al IV-lea sau începutul secolului al V-lea[4].
În Europa, primele şarje de fontă turnată au fost obţinute în Suedia, în secolul al XV-lea (Lapphyttan şi Vinarhyttan). Ghiulele de tun din fontă au permis apoi răspândirea acestui material şi a metodelor de obţinere în toată lumea. Combustibilul de bază pentru aceste procese era cărbunele de lemn (mangalul).
Dispariţia accentuată a pădurilor din Marea Britanie a dus în secolul al XVIII-lea la înlocuirea mangalului cu cocsul, de către Abraham Darby. Acest lucru, împreună cu inventarea maşinii cu abur, a dus la Revoluţia industrială[5].
La sfârşitul anilor 1850, Henry Bessemer a inventat un nou procedeu de fabricare a oţelului cu conţinut foarte scăzut de carbon, la care se sufla aer prin fonta brută topită. Acest progres a dus la diminuarea treptată a producţiei de fier forjat.
Ca abundenţă, fierul este al zecelea element în univers şi al 4-lea pe Pământ (al doilea metal, după aluminiu). Ca masă însă, fierul ocupă primul loc pe Pământ. În prezent se consideră că 80% din nucleul interior al Pământului este format din fier. Sub formă de diverse combinaţii, el formează 5% din scoarţa terestră, însă în stare pură se găseşte doar accidental (în meteoriţi). Se presupune de asemenea că planetaMarte îşi datorează culoarea roşiatică unui sol bogat în oxid de fier.[6]
[modifică] Izotopi
Fierul prezintă patru izotopi naturali. În ordinea abundenţei relative, aceştia sunt: 56Fe (91,7 %), 54Fe (5,8 %), 57Fe (2,2 %) şi 58Fe (0,3 %). De asemenea, se cunosc alţi 10 izotopi sintetici ai fierului. S-a demonstrat (prin corelaţia existentă între abundenţa izotopului 60Ni, un produs de dezintegrare al 60Fe, şi abundenţele izotopilor stabili ai fierului în unii meteoriţi) că 60Fe a existat în stare naturală în perioada de formare a sistemului solar.[7]
[modifică] Forme alotropice
În funcţie de domeniile de temperatură la care sunt stabile şi de structura cristalină, este acceptată astăzi existenţa a 3 stări alotropice ale fierului solid:
- Fierul α are o structură cristalină cubică cu volum centrat şi este stabil de la temperatura ambiantă până la temperatura de 1185 K (912oC). Între temperatura ambiantă şi temperatura de 1043 K (770oC) (punctul Curie), fierul α este feromagnetic, iar peste 1043 K devine paramagnetic. Din această cauză, iniţial formei structurale de fier existente între 1043 K şi 1185 K i s-a dat denumirea de fier β. Ulterior s-a renunţat la această denumire întrucât între fierul α şi fierul β nu există alte diferenţe.
- Fierul γ are o structură cristalină cubică cu feţe centrate şi este stabil între 1185 K (912oC) şi 1667 K (1394oC).
- Fierul δ are o structură cristalină cubică cu volum centrat şi este stabil între 1667 K (1394oC).şi temperatura de topire, 1811 K (1538oC).[8]
Notă: La nivel mondial nu s-a ajuns încă la un acord complet în privinţa poziţiei exacte a diferitelor puncte caracteristice ale fierului (şi nici a punctelor caracteristice din diagrama de echilibru fier-carbon). Valorile indicate aici pentru temperaturi sunt cele întâlnite în monografiile de specialitate uzuale din România.
[modifică] Combinaţii chimice
Fierul formează cu oxigenul combinaţii bivalente şi trivalente. Fenomenul de oxidare a fierului se mai numeşte ruginire.
Oxidul feros, FeO (II), se obţine prin arderea directă a fierului. El este stabil doar la temperaturi de peste 833 K (560oC) şi este de culoare neagră.
Oxidul feric, Fe2O3 (III), numit şi hematit, este un mineral de culoare maronie, obţinut prin oxidarea fierului în condiţiile existenţei unui surplus de oxigen. El reprezintă principala sursă de obţinere a fierului.
Oxidul feric-feros, Fe3O4 (II,III), numit şi magnetit, este materialul natural cu cele mai bune proprietăţi magnetice.
Deşi aceşti oxizi formează straturi protectoare la suprafaţa pieselor, porozitatea acestor straturi este atât de mare încât obiectele din fier expuse efectelor atmosferei ruginesc continuu până la distrugerea lor completă.
Oxidul feric este opac la radiaţii ultraviolete şi infraroşii, proprietate ce îşi gaseşte aplicaţii la fabricarea geamurilor termoabsorbante.
În combinaţie cu carbonul, fierul poate forma soluţii solide sau carbura de fier Fe3 (numită şi cementită). În funcţie de temperatură şi de conţinutul de carbon, soluţiile solide sunt ferita, austenita şi ferita δ.
Pentacarbonilul de fier, Fe(CO)5 se obţine prin reacţia, sub presiune, a fierului cu monoxidul de carbon. Prin descompunerea sa se obţine fierul carbonil cu o puritate de 97,5 %. De asemenea, el se foloseşte pentru obţinerea a numeroşi compuşi ai fierului cu utilizare în sinteza organică.
Tiocianatul de fier, Fe(SCN)3 are o culoare roşie caracteristică şi serveşte la punerea în evidenţă a ionilor Fe3+.
|
Site oficial al grupului scolar "Lazar Edeleanu",judet Constanta,localitatea Navodari.
Site creat pentru a sustine si a vizualiza proiectele si intentiile noastre pe acest site ! |